质粒是ATMP领域中重要的载体工具之一,既可以作为最终产品(DNA疫苗),也可以作为中间生产资料(病毒载体,mRNA药物,细胞治疗药物)。在 CGT 行业中,如何以较低成本实现GMP质粒大规模生产是一项主要需求。宜明生物搭建Ubri-Perfect TM GMP 质粒生产平台,专注于临床级GMP质粒的大规模生产工艺开发,拥有完善的平台化生产工艺以及质量管理体系,可为客户提供从临床前到商业化阶段的环状质粒和线性化质粒一站式服务。
依托全球的前瞻技术研发中心,宜明生物在ATMP领域建立了强大的技术储备池,始终与全球前沿市场的技术保持同步。丰富生产和工艺开发经验,符合NMPA,FDA和EMA等相关法规要求的cGMP厂房设计,已成功帮助全球客户完成18项IND项目获批进入临床,并成功交付近百批次的临床级质粒生产订单。
300+批次GMP级质粒生产
GMP质量管理体系,支持中美IND项目注册申报
专业的生产和检测团队,确保产品高质量交付
定制化方法学开发与验证服务,满足项目的个性化需求

宜明生物拥有专业的GMP质量控制团队,擅长方法学开发,可提供GMP级质粒产品的质量控制方案。宜明生物的质量控制平台涵盖了化学、微生物学、生物化学等方面的检测,可提供多种技术解决方案,助力客户开发、建立基因治疗产品的检测方法,满足所有 GMP 项目的检测要求。
| 检测项目 | 检测方法 |
| 外观 | |
| 目视法 | |
| pH值 | |
| pH值测定法 | |
| 含量 | |
| 紫外-可见分光光度法 | |
鉴别 限制性内切酶酶切图谱分析 目的基因核苷酸序列检查* | |
凝胶电泳 Sanger测序 | |
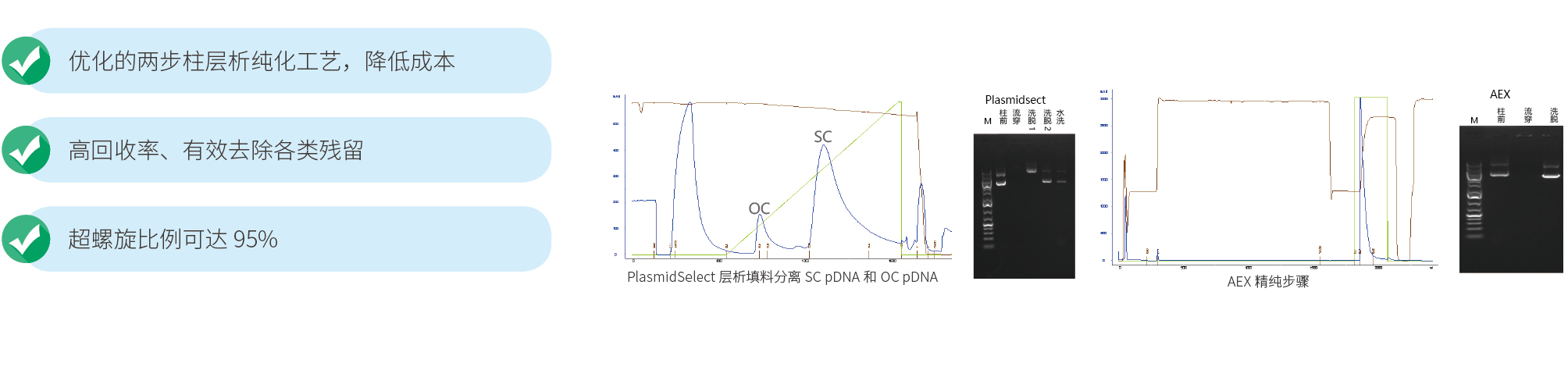
纯度 A260/A280 超螺旋比例* | |
紫外-可见分光光度法 HPLC | |
残留 宿主细胞DNA残留量 宿主细胞RNA残留量 宿主细胞蛋白残留量 | |
qPCR 凝胶电泳/HPLC ELISA | |
安全性 内毒素 无菌检查 | |
无菌检查 薄膜过滤法 |
宜明生物组建了高效的项目管理团队,完善的项目沟通机制和全方面的IP保护,确保每一个CDMO项目的高质量实施交付。
项目管理团队
专业的项目管理团队
对客户需求及时响应
项目沟通机制
定期例会汇报项目进度
线上现场多渠道高效沟通
全方位IP保护
安全的信息加密系统
企业内部项目代码管理
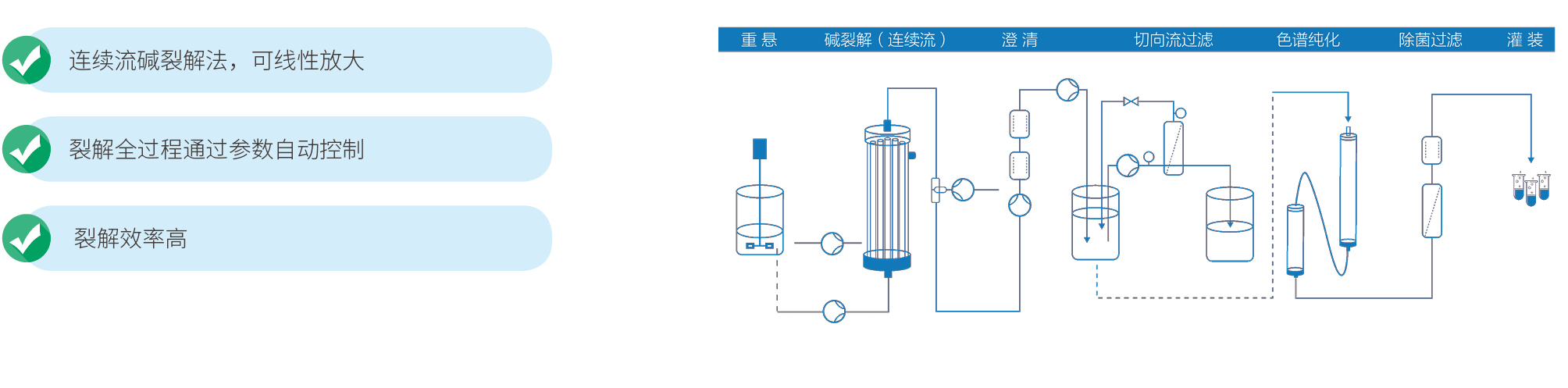
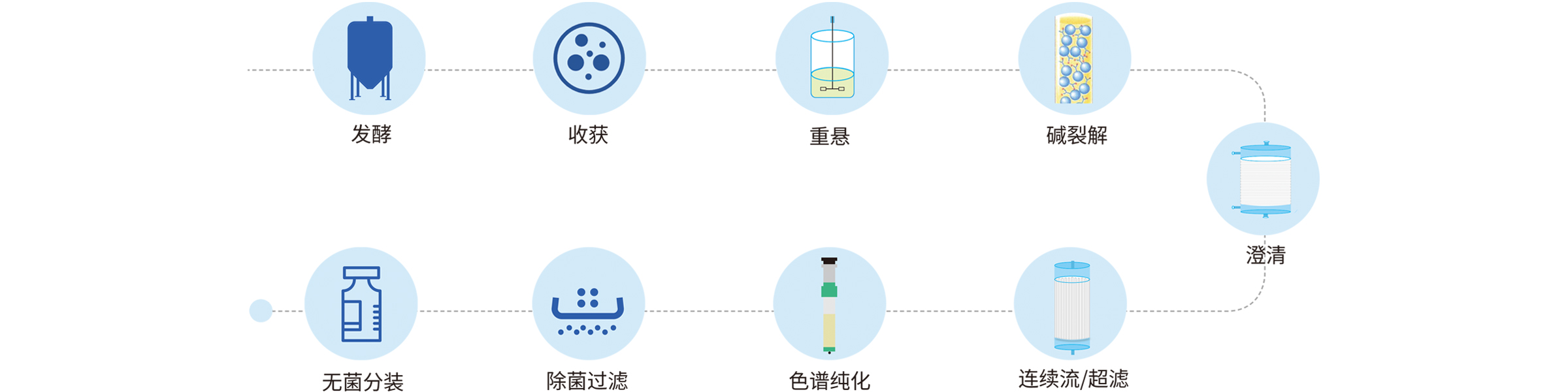
宜明生物建立了成熟的DNA载体工艺平台,丰富的项目经验确保可以实现快速的开发生产流程,为客户提供完整的临床级IND项目服务,包括菌种库、工艺开发、方法学开发、稳定性研究等,亦可以根据项目需求提供定制服务。另外,为满足IND申报的要求,还可提供临床级质粒批生产记录、批检验记录以及相关验证资料等。

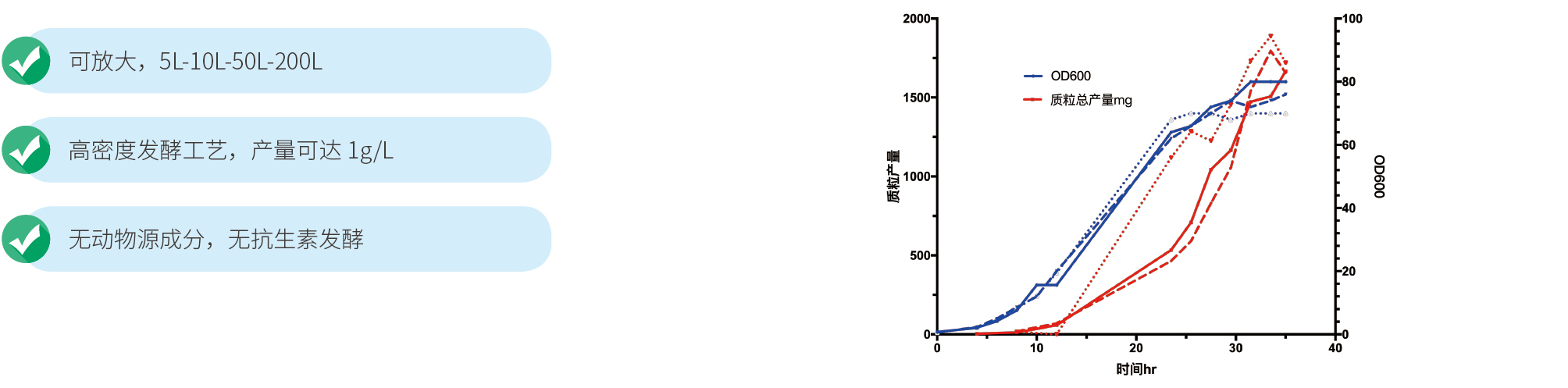
最小的发酵规模是3L,可以放大到200L,通常3L规模,即可达到500mg以上的产量,可满足下游病毒包装的需求。
无菌方法学验证需要对阳性菌的选择、培养条件的选择进行考量。同时,还需要考虑样品的灌装只数。
国家法规要求,构建病毒的质粒应考虑抗生素抗性基因引入的 风险, 一般不得使用氨苄青霉素抗性基因
宜明生物的各生产套件有独立空调、通风系统。质粒发酵为密封的发酵罐。生产线在同一时间只做一种质粒,产品变换前会进行彻底环境清洁,此外,公司有共线生产风险评估文件,可进行现场查阅。

