腺相关病毒(AAV)具备安全性高、免疫原性低、高效持续表达和易于操作等优点,是基因治疗领域备受瞩目的病毒载体。然而AAV生产过程复杂 ,其中放量生产以及产能等一直是AAV商业化生产的主要瓶颈。宜明生物致力于病毒载体的研发与制备,其 Ubri-AdvancedTM GMP AAV生产平台工艺可扩展,可实现50L-200L-500L-2000L商业化生产规模、具备成本效益、可提供覆盖全生产流程的解决方案。
依托全球的前瞻技术研发中心,宜明生物在AAV载体药物开发领域建立了强大的技术储备池,始终与全球前沿市场的技术保持同步。丰富生产和工艺开发经验,符合NMPA,FDA和EMA等相关法规要求的cGMP厂房设计,已成功帮助客户完成4项AAV载体IND项目获批进入临床,并成功交付多个200L、500L的临床批生产订单。
60+批次GMP级
AAV病毒制备
8+不同血清型生产经验,AAV2/2、rAAV2/5、rAAV2/8、rAAV2/9 等
专业的生产和检测团队,确保产品高质量交付
定制化方法学开发与验证服务,满足项目的个性化需求


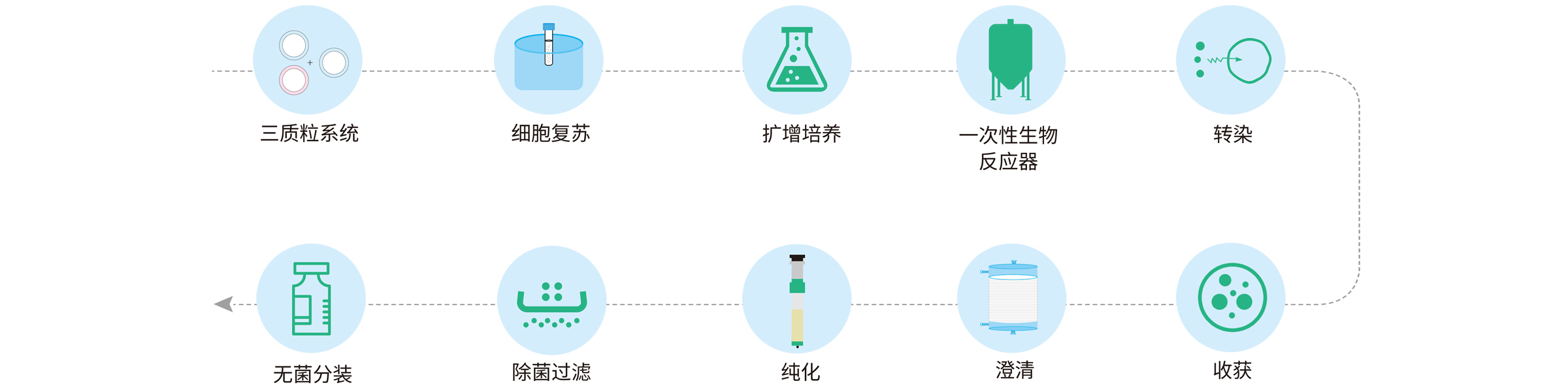
宜明生物的AAV制备平台,采用无血清悬浮培养方式,包括上游的细胞培养、质粒转染以及裂解澄清等,下游的两步柱层析、无菌灌装和储存,整个过程应用一次性以及密闭设备。
宜明生物拥有专业的GMP质量控制 (QC)团队,擅长方法学开发,可提供GMP质粒、AAV 临床级等产品的质量控制方案。宜明生物的质量控制平台涵盖了化学、微生物学、生物化学等方面的检测,可提供多种技术解决方案,助力客户开发、建立基因治疗产品的检测方法,满足所有GMP项目的检测要求。
| 检测项目 | 检测方法 | |
| 鉴别 | ||
| 外壳蛋白鉴别 | CE | |
| AAV基因鉴别 | 一代测序(目的基因) | |
| 纯度 | ||
| 外壳衣壳蛋白纯度 | CE | |
| 空壳率 | ||
| 电镜 | ||
| AUC检测 | ||
| 含量 | ||
| 病毒物理滴度 | ELISA | |
| 病毒基因组滴度 | ddPCR | |
| 病毒感染滴度 | TCID50 | |
| 比活性 | 感染性滴度、基因组滴度 | |
| 杂质 | ||
| 宿主细胞DNA残留量 | QPCR | |
| 质粒DNA残留量 | QPCR | |
| 核酸酶残留量 | ELISA | |
| 宿主细胞蛋白残留量 | ELISA | |
| E1A残留量 | QPCR | |
| Tween-20残留 | HPLC | |
| PEI残留 | HPLC | |
| AAV亲和配基残留 | ELISA | |
| 安全性 | ||
| 细菌内毒素 | 凝胶限度试验法 | |
| 复制性病毒(rcAAV) | 培养法+QPCR | |
| 无菌 | 直接接种法 | |
| 支原体检查 | PCR | |
| 物理检查 | ||
| 外观 | 目视法 | |
| 装量 | ||
| 可见异物 | 灯检法 | |
| pH | pH值测定法 | |
| 渗透压 | 冰点渗透压仪 | |
| 不溶性微粒 | ||
| 光阻法 | 《中国药典》2020版通则0903 | |
| DLS | 企业内控 |
宜明生物组建了高效的项目管理团队,完善的项目沟通机制和全方面的IP保护,确保每一个CDMO项目的高质量实施交付。
项目管理团队
专业的项目管理团队
对客户需求及时响应
项目沟通机制
定期例会汇报项目进度
线上现场多渠道高效沟通
全方位IP保护
安全的信息加密系统
企业内部项目代码管理
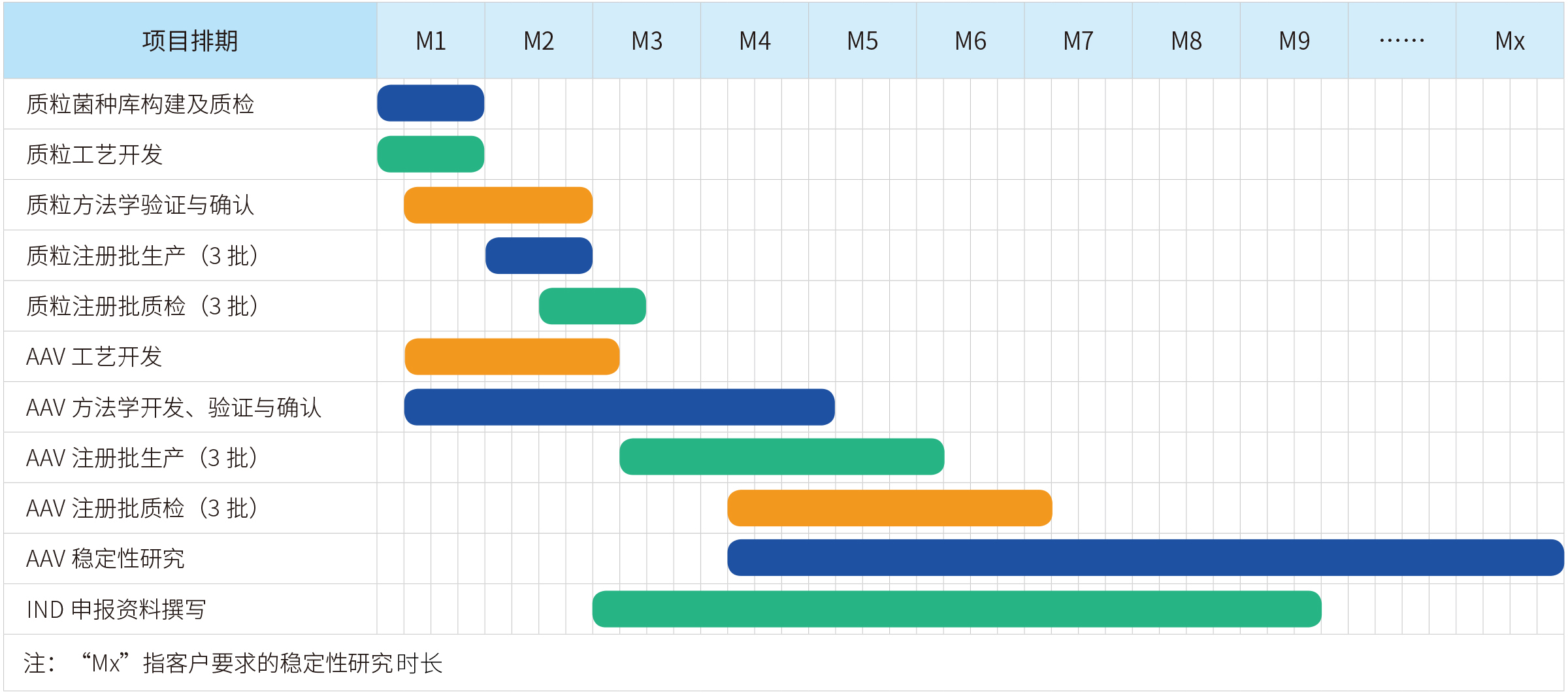
宜明生物建立了成熟的病毒载体工艺平台,丰富的项目经验确保可以实现快速的开发生产流程,为客户提供完整的临床级IND项目服务,包括细胞库建库、工艺开发、方法学开发、稳定性研究,中试批生产等,亦可以根据项目需求提供定制服务。另外,为满足IND申报的要求,还可提供临床级AAV批生产记录、批检验记录以及相关验证资料等。
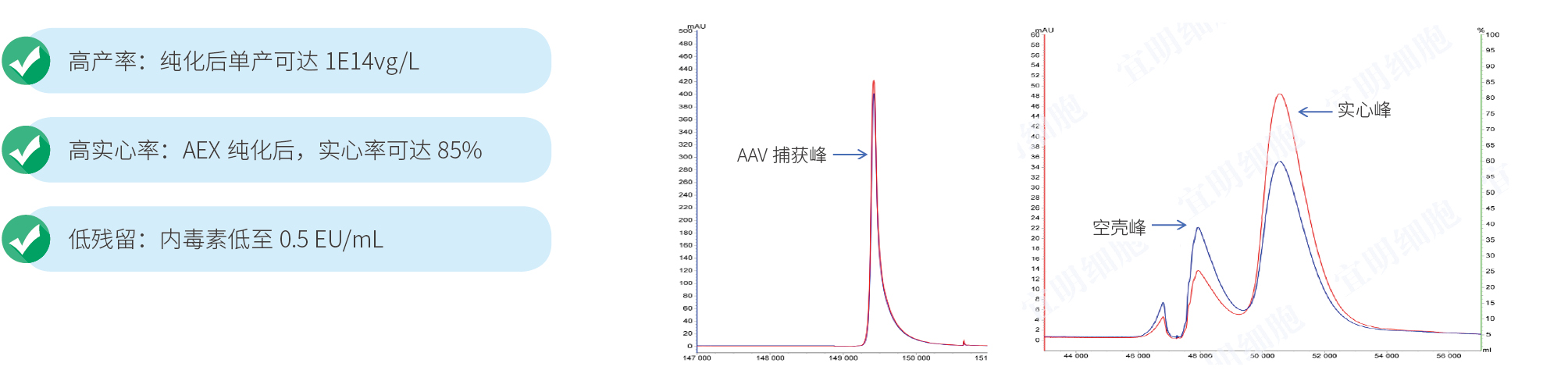
因为眼部产品是倾向于神经元,实际上所有的AAV产品对神经元都有偏好性。目前用于试验类型以AAV2、AAV5和AAV8居多,考虑到专利问题,改造载体如AAV2-7M8、AAV2-tYF等,已被用于临床研究,目前宜明生物参与支持申报的AAV项目中,涵盖了AAV2及其改造载体,AAV8等。
FDA和CDE并没有对空壳率检测设定明确的法规标准。然而,在行业实践中,普遍认为空壳率不应超过30%。具体数值会因AAV的血清型以及表达基因而异,同时也会受到生产工艺的影响,例如,超速离心工艺纯化后的空壳率可能会更低。
免疫原性可以从几个角度考虑。虽然AAV免疫原性不高,但是剂量过高还是会引起一定的免疫反应,所以如何提高药效降低注射剂量是需要从载体设计上进行考量;另外就是产品的纯度,尽量提高实心率,减少杂质是降低免疫反应的必要的措施。
上游主要成本在于培养基、质粒和转染试剂,质粒是最主要的成本;下游成本集中在填料;成品检测的成本也是占比较大的比例。

