经过多年的曲折发展,基因疗法已经在遗传性疾病、传染病甚至常见病等众多疾病领域中展现出令人鼓舞的潜力。基因治疗就是将“好”基因植入病毒载体,再递送至宿主細胞,通过修复或取代“坏”的基因,来治疗由基因缺陷或者突变导致的疾病。目前基因治疗领域常用的病毒载体有腺病毒、慢病毒、腺相关病毒(AAV)以及逆转录病毒等,其中AAV因其免疫原性极低、安全性高、宿主细胞范围广、扩散能力强、表达稳定以及特异性强等优势脱颖而出。
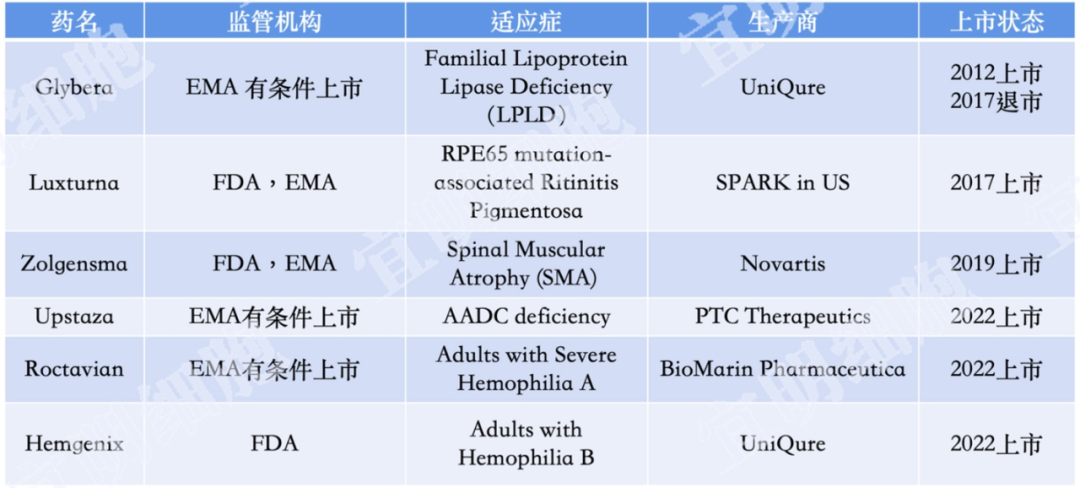
表一:截至2022年12月, FDA已批准三种AAV产品上市,EMA已批准5种AAV产品上市/有条件上市
尽管AAV基因治疗药物已显示出巨大的前景,但是AAV的工业化生产和供应链仍是行业发展的主要痛点之一。其中AAV载体纯化工艺的种种问题,如空衣壳的去除等,都使得AAV的生产成本与复杂程度大幅度增加。本文将简要讨论AAV生产工艺下游纯化工艺的挑战。
AAV病毒载体的生产流程分为上游病毒包装和下游病毒纯化。上游目的是完成AAV在细胞中的包装生产,下游目的是将上游加工生产的病毒载体从各种杂质中分离出来,使得最终产品符合质量标准的要求,并能应用于临床。下游的纯化工艺除了提供高纯度产品,还需要具有可放大性,可用于大规模生产,能满足较大规模临床试验以及后期商业化的需要。
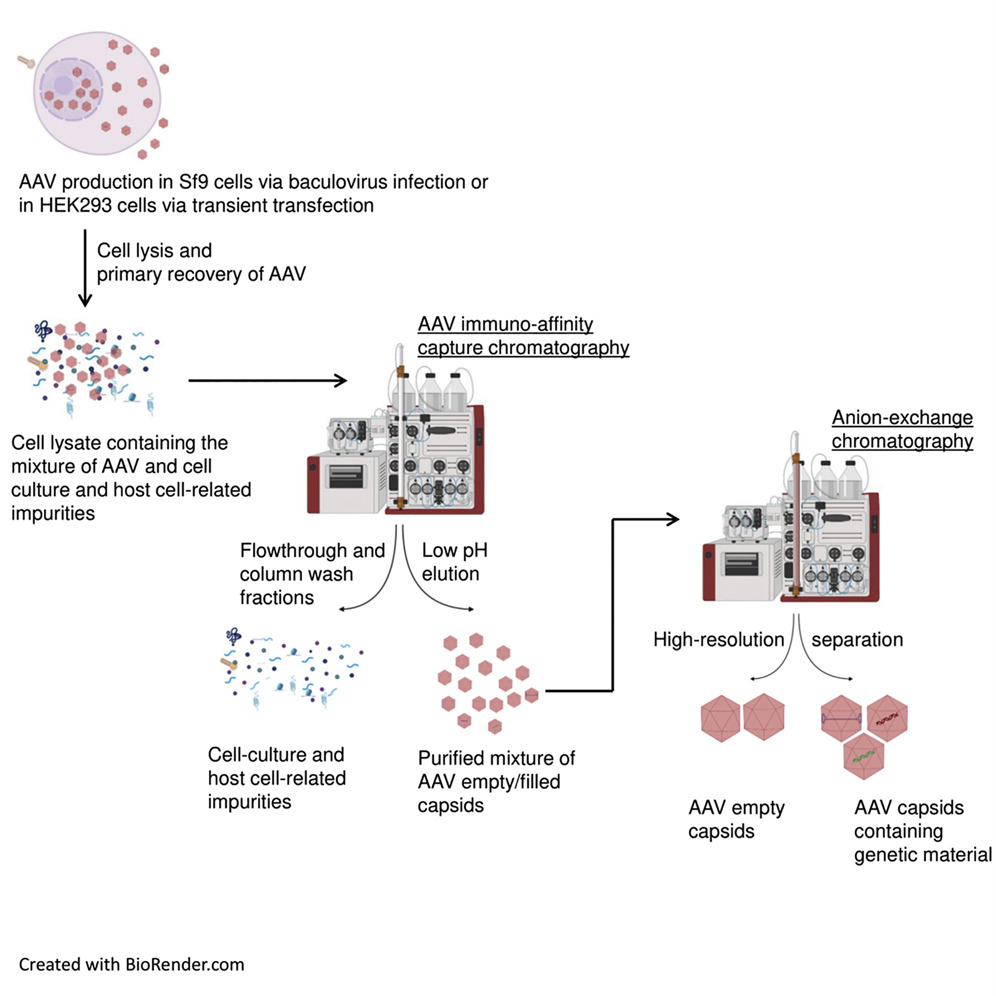
图一:AAV的生产流程概述(源自DOI:https://doi.org/10.1016/j.omtm.2021.03.016)
AAV生产过程中产生的杂质大致有两类。一类源于生产工艺中的原材料和组分,包括细胞底物、细胞培养基以及辅助组分(如病毒和质粒DNA)等,如表一所示。另一类与AAV产品自身性质有关的杂质,如空衣壳,后面将详细介绍。
1、生产相关杂质
宿主细胞DNA残留的担忧是基于致癌风险理论,特别是生产细胞系所包含的致癌序列,比如最常见腺病毒基因E1A和E1B(HEK293, PerC.6 和CAP 细胞系),人乳头瘤病毒E6和E7基因(HeLa细胞系)等。当使用致癌细胞系生产AAV时,下游纯化须尽可能减少残留DNA。工业上一般使用核酸酶分解残留DNA,普遍认为小于200 bp的DNA片段可显著降低致癌风险。
宿主细胞蛋白残留与免疫原性、炎症或过敏性休克有关。尽管与非人类的生产原料相比(非人类细胞系如BHK21或昆虫细胞,以及辅助病毒如HSV、腺病毒、杆状病毒),人类细胞免疫原性比较弱。但是考虑到AAV较大的治疗剂量,宿主细胞蛋白以及病毒蛋白相关的风险就不容忽视,因此在下游生产过程中必须尽可能减少蛋白残留。
另外在上游过程中可能会引入其他杂质,比如培养基所含的胎牛血清(BSA)、分解DNA的核酸酶、破坏细胞的洗涤剂,以及可能使用的辅助病毒(如HSV、腺病毒或杆状病毒)等,因此对上游的生产原料须加以控制,尽可能避免有毒性的原料。
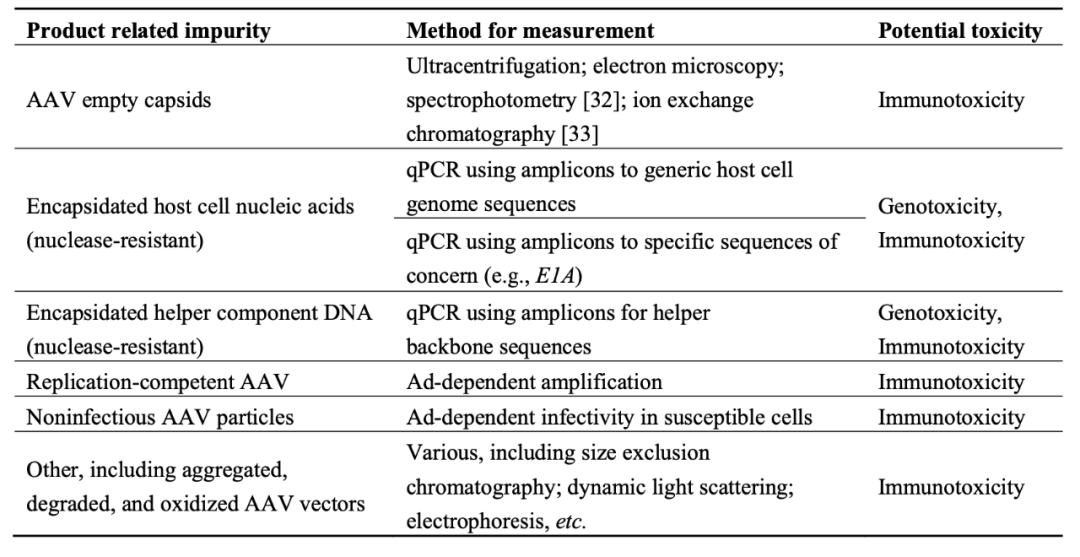
产品相关性杂质是指在生产或存储过程中形成产品的分子变体,包括生物合成过程的中间产物、包装内容物不正确的病毒颗粒(空衣壳/部分衣壳,包装残留质粒或宿主细胞 DNA 的类 AAV 病毒颗粒),以及降解的、氧化或是聚集的载体。这类杂质并无治疗效果,而且存在安全隐患。表2列出了与AAV载体产品相关杂质,包括表征方法及其潜在毒性。
表二:与AAV载体产品相关的杂质
(源自:https://doi:10.3390/biomedicines2010080)
目前三种AAV载体的生产体系(三质粒瞬转体系、杆状病毒表达载体体系以及包装细胞体系) 中都会出现三种衣壳:完整衣壳(full capsid)、部分衣壳(partial capsid),和空衣壳(empty capsid)。其中完整衣壳包含正确的DNA序列,是人们所期待的产品;部分衣壳和空衣壳包含部分不包含目的基因,属于生产中的杂质,约占细胞生产的总AAV颗粒的50%-90%。
空衣壳/部分衣壳有如下几种危害:1), 影响产品的纯度,2), 增加最终产品的免疫原性,3), 与完整衣壳竞争感染细胞上的载体结合受体,抑制完整衣壳的转导,4),增加总体病毒载量。部分衣壳与空衣壳地存在严重地影响了AAV产品的安全性和有效性,因此监管机构强烈建议在整个生产过程中监控空/完整衣壳比(空壳率)。
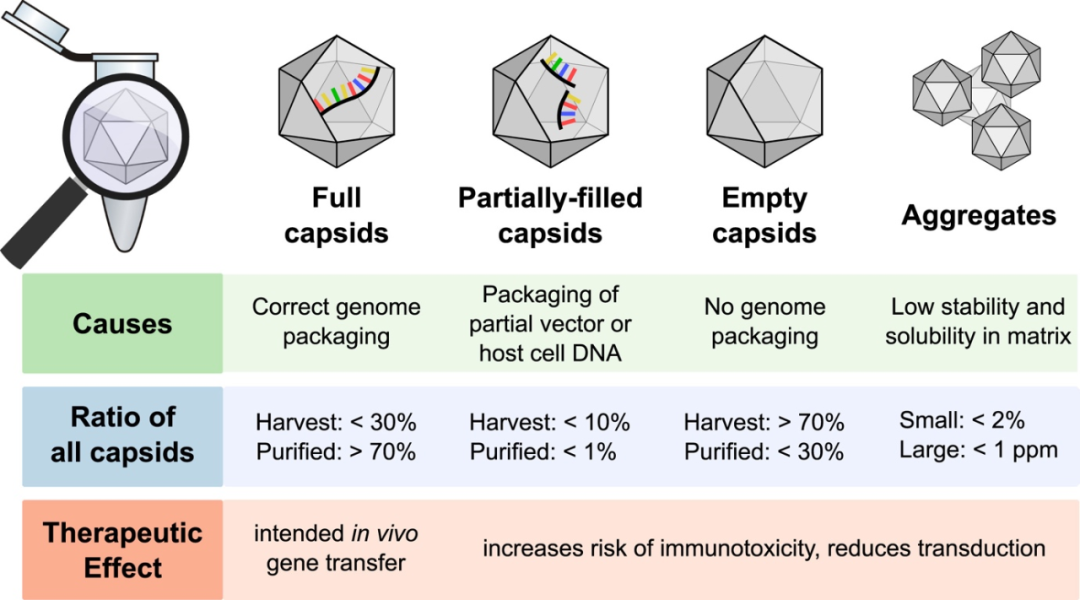
图二 :AAV制备过程中所产生的病毒颗粒类型
(源自:https://doi.org/10.1016/j.omtm.2021.02.010)
在AAV载体制备中减少空衣壳一般两种方法:一是优化上游载体生成条件,提高包装效率,减少空衣壳的比例;二是优化下游纯化工艺,有效地去除空衣壳。
氯化铯(CsCl)/碘克沙醇密度梯度离心大概是最古老的最传统的AAV纯化技术了。这种技术适用于所有血清型且分辨率高,但是因生产工艺很难放大,低通量等缺点阻碍了其在工业中的应用。继密度梯度离心之后,色谱法不断发展,并逐渐成为一种成熟的、主流的方法。色谱法通过载体的净电荷、疏水性、对配体的亲和性、大小以及其他性质来分离并纯化载体。这类技术有诸多的优点:更具可扩展性和成本效益,可多次重复使用,可并行运行或串联运行,还可有效去除非定植剂,这是开发后期的一个关键方面。本文重点介绍色谱法中的亲和层析以及离子交换层析。
1、亲和层析(Affinity chromatography,AC)
AAV下游纯化工艺中最常见的第一步是使用亲和层析法从细胞裂解物中捕获衣壳。
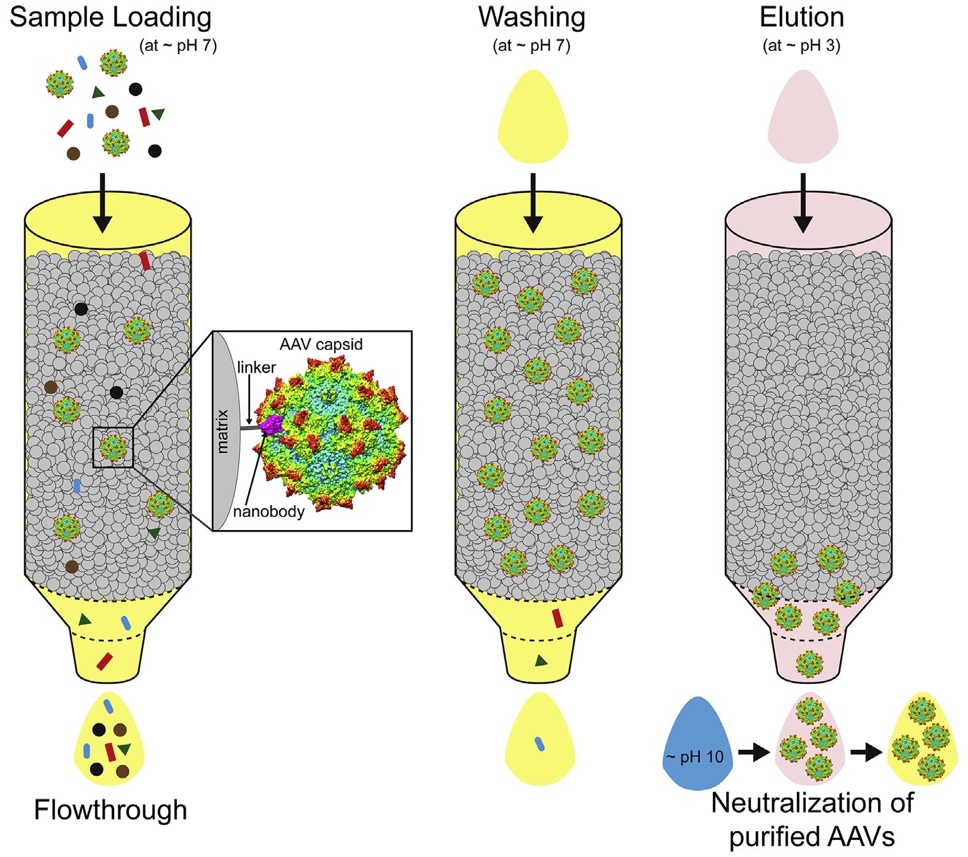
图三:亲和层析AAV的纯化,通过AAV与填料的基质上偶联的抗体或纳米体地特异性结合来实现
(源自:https://doi.org/10.1016/j.omtm.2020.10.001)
最早一代的亲和层析是肝素亲和层析(Heparin affinity chromatography)。缺点在于结合背景高、动物源性(骆驼科动物衍生的配体),并且只限于某些AAV血清型(主要用于AAV2)。硫酸化纤维素,CellufineTM sulphated cellulose,是肝素树脂的替代材料,两者亲和性相似。
AVB Sepharose High Performance是近年来亲和层析类的明星产品,可以纯化多种AAV血清型,AAV变种和人工合成的衣壳,具有强大的载体结合能力、可接受的浓度和较高回收率,已经在商业化生产中广泛使用。
AVB与AAV的亲和力因血清型而异,例如AVB与AAV3的亲和力很强,但是与AAV8和AAV9的亲和力就很弱。差异的原因在于AAV的衣壳可变区是否存在一个序列为SPAKFA的AVB结合表位。研究人员将(与AVB结合力弱的)AAV8、rh.64R1, AAV9、 AAV-DJ或AAV-DJ/8等相应位置的序列替换为SPAKFA后,就极大地提高了这些血清型与AVB树脂的结合,而且不影响效力。
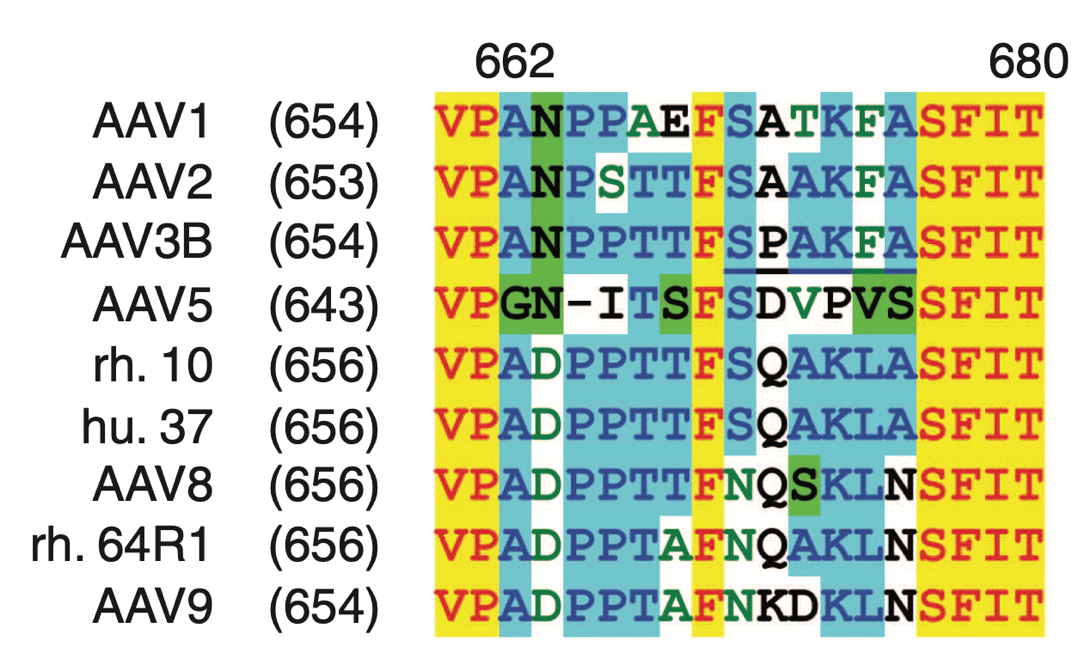
图四:AVB结合表位 “SPAKFA”
(源自:https://doi.org/10.1016/j.omtm.2020.10.001.)
除了AVB亲和柱,POROS CaptureSelect Affinity 树脂也受到了越来越多的关注。这种树脂不仅具有强大的AAV颗粒结合能力(每毫升树脂结合约1014 vg),还可以用于AAV8和AAV9的纯化,且回收率较高(AAV8~80%,AAV9~73%)。POROS树脂纯化效率很高,一次纯化即可有效地减少杂质;与AKTA设备相结合后可用于大规模AAV的纯化。
有趣的是,POROS树脂并不像ABV树脂那样凭“特定的序列”与AAV结合,比如AAVrh8R 与AAV9更相似,但是只能用POROS AAV8树脂纯化;而AAV-DJ与AAV8在很大程度上是同源的,但AAV-DJ却不能用POROS AAV8树脂纯化。因此在使用POROS系统纯化某一特定AAV时,必须进行测试。
POROS™ CaptureSelect™系统又开发出AAVX 亲和树脂。POROS AAVX可用于广泛的血清型,包括 AAV1-8、AAVrh10以及其他一些合成的血清型。
离子交换层析 (IEC) 是一种简单、通用且经济高效的技术,已成为许多载体纯化的关键步骤。IEC分为阴离子/阳离子交换柱,其中AEC(Anion-exchange chromatography)适用于AAV纯化,是大规模AAV生产中去除空衣壳的主要手段。
AAV衣壳亚种之间因表面电荷的差异导致不同的的等电点。空衣壳PI在6.3左右,包装了完整基因组DNA后的病毒颗粒PI大致为5.9。AAV与基质之间的静电相互作用正是取决于衣壳的等电点(pI)和缓冲液的pH值。基于这一原理在正电荷固定相上进行样品的分离纯化,去除杂质(如空衣壳和部分衣壳),并有效地回收目的载体。
尽管AEC理论上可以用于所有AAV血清型中的空衣壳的分离去除,但事实上,还是要就不同的血清型对树脂以及纯化条件进行优化。另外任何影响载体电荷的因素,如血清型、载体设计或转基因插入的长度,都可能需要重新优化纯化条件。
毫无疑问,AAV生产下游纯化至关重要,但如果在下游纯化阶段盲目追求高纯度,往往会造成产量的损失。宜明生物董事长兼首席技术官孙秀莲博士解释道:“下游纯化环节并非孤立存在,上游生产细胞系的选择、生产流程的设计、生物反应器性能与操作、生产原料的选择与把控,都很大程度影响下游纯化的效率。我们需要在产量与质量的矛盾中找到解决方案。”

图五:宜明生物的生物反应器(部分)左上:WAVE25/50,右上:200L一次性生物反应器细胞培养;左下,500L一次性生物反应器细胞培养;右下:2000L一次性生物反应器细胞培养
以宜明生物Ubri-AdvancedTMGMP级别AAV生产平台为例:
在上游生产阶段,宜明生物自主驯化了用于AAV病毒生产的293XS细胞株(该细胞株已获得国家知识产权局颁发的发明专利证书)。293XS培养密度可达1E7 cells/ml,可实现50L-200L-500L-2000L规模细胞培养 ,AAV产率可超过1E14VG/L。高产量可以减轻下游纯化阶段的压力(见图五)。
经过对载体以及转染体系的优化,提高了AAV包装效率,从而减轻在AEC步骤去处空衣壳的负担(见图六)。孙博士说:“这种较低的空衣壳负载,叠加对AEC技术空间的不断开发,使平台实现更高的可扩展性和产品一致性。”
该平台无血清、无动物源性生产原料、无抗生素、无辅助病毒等,减少了外源性杂质的引入,缓解了下游纯化的压力。
可扩展的两步法纯化流程,可用于多种血清型的纯化,包括rAAV2/2、rAAV2/5、rAAV2/8、rAAV2/9。在两步法纯化后实心率高达85%,空壳率则低至8%。部分衣壳低至6%(见图六)。
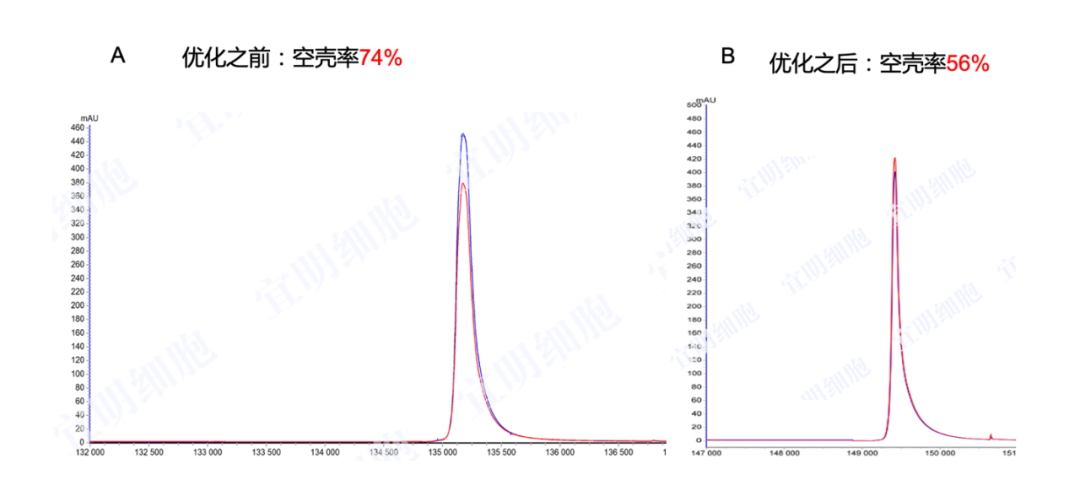
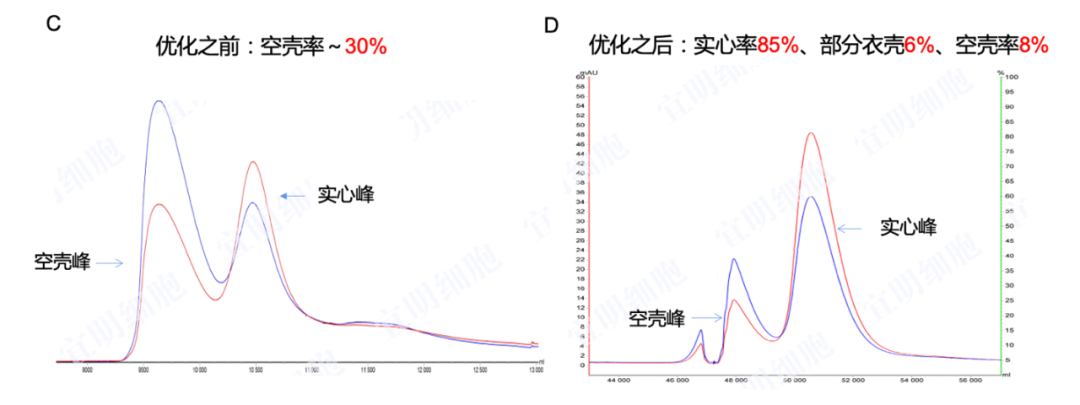
图六: 载体以及转染体系优化前后AAV空壳率的比较(200 L)。图A和B:经第一步亲和层析捕获后,AAV空壳率由优化前的74%降至56%;图C和C:经第二步AEC纯化后,AAV实心率为:85%;空壳率为8%;部分衣壳为6%。(数据来源:宜明生物)
宜明生物董事长兼CTO孙秀莲博士说:
宜明生物Ubri-AdvancedTMGMP AAV生产平台非常稳健,目前已经成功完成约30批次的GMP AAV生产,2022年共有三款宜明生物提供全程CDMO服务的AAV基因药物IND申请快速获批*。我们的Ubri-AdvancedTMGMP AAV生产平台可以为CGT新药企业提供更高滴度、高纯度以及高度一致性的合规的AAV产品,并通过不断地技术创新,降低新药成本,让新药、好药惠及尽早更多患者。
*:与宜明生物合作的四款获批NMPA IND的分别是天泽云泰的“VGR-R01”和“VGB-R04 ”、朗昇生物的“LX101”以及微知卓的生物人工肝产品——血浆生物净化柱,其中前三款是AAV基因药物。
参考资料:
1.https://doi.org/10.1002/biot.202000025
2.https://doi.org/10.18609/cgti.2018.016
3.https://doi:10.3390/biomedicines2010080
4.https://doi.org/10.1016/j.omtm.2021.02.010
5.https://DOI: 10.18609/cgti.2019.110
6.https://DOI 10.1007/s40259-01702345
7.https://doi.org/10.1016/j.omtm.2020.10.001
8.https://doi.org/10.1038/s41467-021-21935-5
宜明生物:https://www.ymbiologics.com/

