辉瑞/BioNTech和Moderna COVID-19 mRNA疫苗的成功推动了核酸药物的崛起。目前 mRNA的应用方向主要涉及:针对传染性疾病的预防性疫苗,针对肿瘤的治疗性疫苗,蛋白替代疗法,及基因编辑等。但是mRNA有很多缺点。首先mRNA必须经过修饰才能抵抗核酸酶降解并逃避先天免疫激活。第二mRNA的包裹有难度、价格昂贵,且修饰后的mRNA寿命依然不长,从而限制了治疗性蛋白的产量影响治疗效果。
幸运的是,在方兴未艾的RNA药物世界里,circRNA作为一种新型的、可传递遗传信息的多功能治疗介质,因其卓越的稳定性而有望成为mRNA有潜力的替代方案。根据2022年的一项调查,基于circRNA的疗法已然一跃成为《自然-生物技术2021》的六个重要学术衍生产品之一,也是药物研发公司的主要关注点之一。2022年,默克公司与Orna Therapeutics达成了价值高达35亿美元的circRNA项目的合作(Orna Therapeutics公司是circRNA领域的先驱者)。
考虑到mRNA和circRNA在治疗性蛋白表达中的作用机制相似,这使得将mRNA的治疗应用扩展到circRNA成为可能。本篇将简单介绍circRNA疗法的潜在应用,并讨论其作为治疗介质使用的优势与挑战。
circRNA用于蛋白替代疗法
蛋白替代疗法的目的是恢复因基因突变所导致的缺失/缺陷的蛋白功能,将编码功能性内源蛋白的mRNA递送至靶细胞和组织,以恢复健康的表型。大多数无法治疗的罕见疾病是基因功能缺失型,蛋白替代疗法可以为这类疾病提供低风险的治疗,如血友病、甲基丙二酸血症、治疗囊性纤维化等。
1.与mRNA相比,circRNA蛋白替代疗法以下有几个优势。
更稳定
circRNA的结构赋予其更高的稳定性并更长的蛋白表达时间,因此与mRNA相比,circRNA的替代疗法可以实现产量更高、更持久的蛋白表达水平。circRNA的替代疗法可以更长时间地表达相关的治疗蛋白,并有可能降低给药频率。
低免疫原性
mRNA有较高的免疫原性,可以通过病原体识别受体可以激活先天免疫系统,引发干扰素翻译并抑制mRNA的治疗作用;免疫刺激还可引发针对编码产物不必要的免疫反应,从而抑制其功效。相比之下,由于缺乏末端的,未修饰的circRNA不易被病原体识别受体识别,具有较低的免疫原性。考虑到其较低的免疫原性和较高的再给药潜力,这使得circRNA更适合于蛋白替代疗法的应用。
2.circRNA蛋白替代疗法也同样面临着挑战
递送系统的突破。脂质纳米颗粒(LNP)是临床上比较先进的包裹并递送RNA到靶器官的载体。由于大多数LNP通过全身给药后可定位于肝脏,因此大多数蛋白替代疗法都局限于肝脏可表达的蛋白。研究人员也在考虑吸入给药方式,但其给药效率低于全身给药。未来有必要创新LNP的配方和定向输送,以扩大蛋白替代疗法的在肝外组织的应用。
circRNA和mRNA蛋白表达缺乏微调机制。治疗性蛋白的表达需要达到适当的功能水平,有效且不能超过毒性限度。内源蛋白的表达是通过基因水平的调控机制和反馈回路来精准控制的,但是对于外源性工程RNA来说,只有少数的小分子调控机制参与控制。进一步开发可控的工程化circRNA,实现精准调控蛋白表达,增加治疗的疗效与安全性。
免疫原性。尽管工程化circRNA的免疫原性低于mRNA,但circRNA仍然可以激活先天免疫系统。Chen等人(2017)首次表明,转染工程化circRNA可刺激几种免疫基因的表达,最显著的是维甲酸诱导基因- i (RIG-I)。造成工程化circRNA免疫原性的原因可能有以下几点:
circRNA生物发生的内含子,由内源性人ZKSCAN1内含子产生的circRNAs不具备免疫原性,但是利用T4噬菌体胸腺苷酸合成酶(td)基因的I型内含子则具备免疫原性(见图1A)
m6A修饰促进了环化,降低了免疫原性(见图1A)
circRNA制剂中少量线性RNA杂质可以引起强烈的细胞免疫反应
外显子残余物可以形成双链二级结构,激活PKR(见图1C)
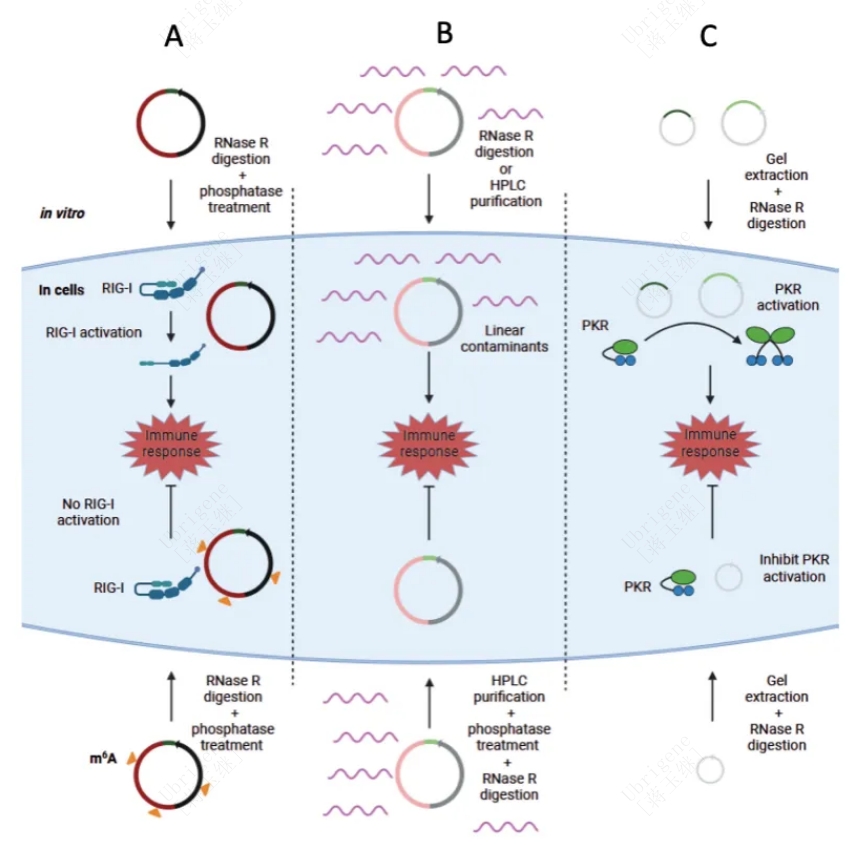
图一|circRNA的免疫原性。(A) 工程化circRNA通过RIG-I诱导强烈的免疫反应,但m6A修饰的circRNA会消除免疫反应。(B)工程circRNA不具有免疫原性,但若纯化不完全,含有5 '三磷酸的线性RNA杂志可以刺激细胞因子释放。(C) 通过PIE自催化剪接包含在circRNA中的残体可以通过PKR激活免疫反应。没有残余片段的circRNA会抑制PKR的激活。(doi/10.1093/jmcb/mjad002/7036773 )
circRNA在疫苗领域的应用
早在上个世纪 90 年代人们就提出了mRNA疫苗的概念。mRNA疫苗技术是将携带病毒抗原的遗传信息(特定的病毒信息)的mRNA分子递送至免疫细胞,免疫细胞表达相应的蛋白(病毒抗原)。这些蛋白分子可以诱导所需的适应性免疫反应,从而精准且迅速地为机体提供保护。mRNA疫苗免疫原性更强、无需佐剂、研发生产周期较短且生产工艺相对简单,在面对易突变的病原体(如流感病毒),以及突发病毒(如新冠病毒、埃博拉病毒、寨卡病毒等)具有明显优势。但是mRNA疫苗的应用受其不稳定性、低效率和先天免疫原性的限制,而结合IRESs和ORF的circRNA疫苗则提供了一种改进的RNA疫苗方法,安全、稳定、且制造简单性和可扩展性。
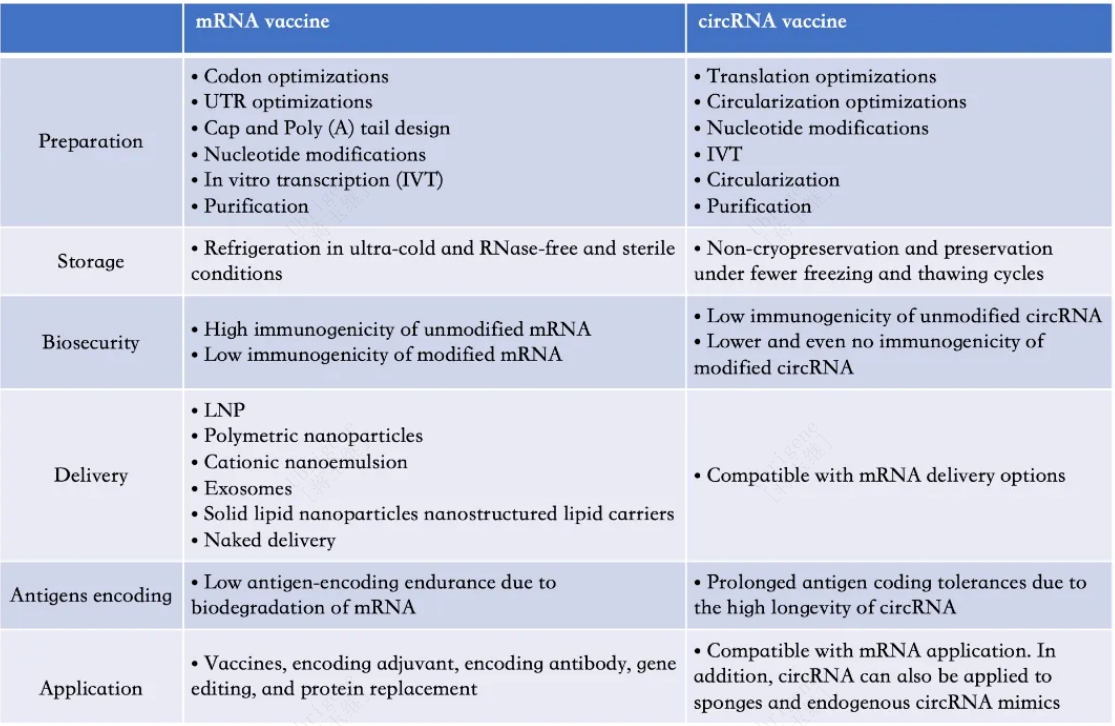
circRNAs疫苗具有多种优势(见表1)。
circRNAs更稳定且易于储存,无需修饰。mRNA疫苗表现出极端的不稳定性,因为它在运输、储存、递送等过程中容易被RNA酶降解。尽管mRNA主链和UTR区域的核苷酸修饰使mRNA更稳定,但同时也使制造过程复杂化并增加了生产成本。由于疫苗的热稳定性不佳,因此疫苗的储存仍然需要低温冷链。无需任何修饰的cirRNA表现出高稳定性和更好的抗Rnase水解的能力,可以在室温或反复冻融条件下储存。
未经修饰的circRNA副作用更少。mRNA疫苗引起的细胞毒性和副作用部分缘于其高免疫原性。与高免疫原性的修饰mRNA相比,未修饰的circRNA表现出较低的免疫原性和较低的细胞毒性。
circRNAs可以延长的蛋白持续表达的时间,这有助于抗原留在抗原呈递细胞(APCs)中并延长抗原呈递。这些因素促进了适应性免疫反应的有效触发和中和抗体数量的增加。
表一|mRNA疫苗与circRNA疫苗的比较
(doi.org/10.1038/s41392-023-01561-x)
circRNA疫苗和mRNA疫苗有许多相似之处,尤其重要的是,circRNA可以弥补mRNA疫苗的多重缺陷。尽管circRNA疫苗在设计、合成、纯化、递送和应用方面都处于早期阶段,circRNA有望成为新一代基于RNA的疫苗平台。
circRNA在肿瘤疫苗中的应用
mRNA 在癌症疫苗中的应用非常广泛,通过多种策略实现抑制肿瘤甚至清楚肿瘤的目的(见图二)
抗原呈递:mRNA 疫苗将癌症抗原递送至抗原呈递细胞 (APC),以呈递主要组织相容性复合物 I 类和 II 类。
辅助功能:mRNA 通过与 APC 表达的模式识别受体结合来刺激免疫激活。
抗原受体:mRNA 将嵌合抗原受体 (CAR) 或 T 细胞受体等抗原受体引入淋巴细胞。
蛋白生产:mRNA 允许免疫调节蛋白的表达,包括 Toll 样受体、趋化因子受体、共刺激配体、细胞因子、趋化因子和不同的单克隆抗体格式进入不同的细胞亚群。
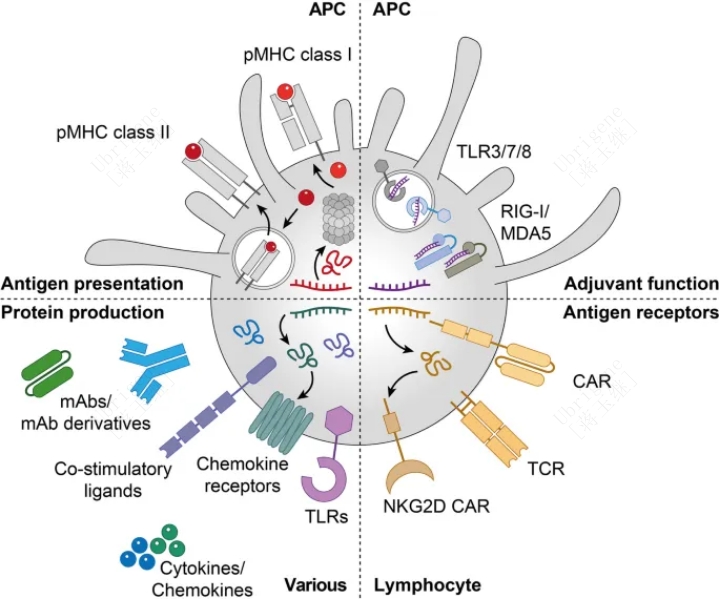
图二|mRNA肿瘤疫苗的工作原理概述
(https://doi.org/10.1186/s12943-021-01348-0)
目前的mRNA肿瘤疫苗在免疫诱导等方面表现不佳,而circRNA先天优势使其在肿瘤疫苗领域颇具前景。
circRNA的稳定性使得治疗性蛋白稳定表达。与预防性病原体疫苗一样,癌症疫苗可以从延长抗原呈递中获益,从而产生更强的免疫反应。对于细胞治疗,CAR的长期瞬时表达可以导致强的免疫反应,且安全。
应用circRNA可能会提高癌症疫苗的免疫原性,使免疫刺激蛋白在癌症免疫治疗中可以更好地激活免疫系统。circRNA表达小扩散蛋白(如细胞因子和小抗体片段)的持续时间延长,可以更好地将免疫细胞招募到肿瘤部位。
可定制的circRNA可以实现适应个体癌症,以进行精确的癌症治疗。多种抗原还可以在不同的circRNA上编码,接种多种新抗原可以降低癌症逃逸和复发的风险。
利用circRNA的稳定性,研究人员通过将表达CAR的circRNA引入T细胞,直接合成嵌合抗原受体(CAR) T细胞,简化了T细胞分离再进行工程化生产CAR-T细胞的繁琐过程。
circRNAs固有的低免疫原性是肿瘤内免疫激活蛋白表达的优势。而未修饰的mRNA可激活先天免疫系统,降低抗体表达,阻止适应性免疫细胞对肿瘤的有效招募。
circRNA不依赖于cap的翻译起始机制可以使其不受癌细胞状态的影响,可靠地翻译免疫激活蛋白(如细胞因子和抗体),即使对处在静止状态的癌症干细胞亚群,circRNA也可保持稳健的翻译。
用于基因编辑的circRNA
circRNA拓扑结构的稳定性使其在基因编辑领域大有可为。基因编辑系统中的gRNA与模板RNA环化后,都可获得更大的稳定性和更好的编辑效率。circRNA也有望用于编码基因编辑系统中的Cas9等。与mRNA相比, circRNA可更稳健地表达,使Cas9蛋白表达时间更持久性,蛋白表达量更高,相应地编辑效率也更高。
另一方面由于线性RNA的免疫原性可能干扰蛋白的产生并触发清除编辑细胞的免疫反应,基因编辑需要无免疫原性的RNA。因此,免疫原性较低的circRNA有望成为基因编辑元件更为合适的介质。
但是,circRNA在基因编辑领域的应用还有很多挑战。
基于RNA的基因编辑元件递送到靶组织才能产生治疗效果。目前递送的载体主要有病毒载体与非病毒载体等。以AAV病毒载体为例(这是当下CGT领域最为先进的载体之一),其生产制造的挑战、免疫原性以及载荷限制等问题都限制了这一载体应用。若选择非病毒载体递送mRNA和/或circRNA, 只能到达数目有限的几种靶器官。因此寻找适合的递送系统,扩大可应用的靶器官的范围是未来circRNA以及mRNA的挑战。
基因编辑疗法,尤其是Crispr/Cas9 衍生的编辑技术,有脱靶的可能性。脱靶可能破坏细胞内的重要基因并有致癌风险。控制编辑蛋白表达的持续时间是降低脱靶率的可行策略之一。然而circRNA的稳定性延长了蛋白表达的时间,可能增加脱靶的几率。目前还没有研究调查mRNA与circRNA表达的Cas9的脱靶率。
由于环状结构,circRNA capacity 有限。考虑到许多基因编辑蛋白都很大,如Cas9 大约4kb,而目前鲜有报告称可以合成5kb或以上的circRNA。Cas9的大小可能超过circRNA容量,这使得有效环化具有挑战性。为了克服这种尺寸限制,研究人员探索了各种策略。一种方法使用截短的Cas9版本, 另一种策略是将Cas9蛋白分成两个或多个片段,单独表达并在细胞中重新组装成功能性的Cas9。
免疫原性是基因编辑疗法的另一个问题。circRNA和Cas9都可以具有免疫原性,诱发免疫反应,移除编辑过的细胞。目前高达78%的人群已经对Cas9蛋白免疫,这进一步增加基因编辑疗法的挑战。尽管circRNA的免疫原性比较低,但还需要更多的研究来证明circRNA的低免疫原性能否足以避免编辑过程中的不良免疫反应。
Ref:
doi: 10.1038/s41467-018-05096-6
doi: 10.1038/s41587-022-01530-9.
doi.org/10.1016/j.addr.2023.114826
doi/10.1093/jmcb/mjad002/7036773
doi:10.16476/j.pibb.2021.0288
doi.org/10.1038/s41388-023-02780-w
doi: 10.1016/j.molcel.2019. 02780-w
doi.org/10.1038/s41392-023-01561-x
doi.org/10.1186/s12943-021-01348-0
doi: 10.13376/j.cbls/2021045
doi.org/10.1155/2016/1740936
doi: 10.1155/2018/1652567
doi.org/10.1016/j.omtn.2023.06.002
doi:10.3389/fgene.2022.823238
doi: 10.14218/MRP.2018.024
https://www.fiercebiotech.com/biotech/merck-bets-big-circular-rna-paying-150m-and-dangling-35b-biobucks-work-orna

